保存硫酸亞鐵要加入稀硫酸和鐵粉:加稀硫酸防止Fe2+水解,加鐵粉防止Fe2+氧化,。有人提出異議 :“ 加人的鐵粉和稀硫酸要發(fā)生反應(yīng),,如何防止Fe2+解和氧化呢?”有人解釋:“純鐵粉和硫酸反應(yīng)不能完全進(jìn)行,,存在限度,。”似乎這樣解釋有點(diǎn)牽強(qiáng)…有的認(rèn)為純鐵粉和稀硫酸反應(yīng)速度慢;有的認(rèn)為純鐵粉和稀硫酸反應(yīng)不能完全進(jìn)行,。鐵粉,、硫酸在保存硫酸亞鐵溶液的作用是什么?硫酸亞鐵溶液應(yīng)該如何保存,?長隆科技就此問題進(jìn)行了探究,。
實驗探究和現(xiàn)象解釋:實驗中涉及的化學(xué)反應(yīng)
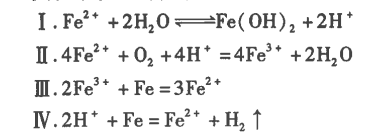
用電子天平準(zhǔn)確稱取2.78gFeSO4.7H2O溶于水,定容,準(zhǔn)確配制100mL0.1mol/LFeSO4溶液待用。
新配制FeSO4溶液 的性質(zhì)探究
新配制FeSO4溶液顯淡綠色m用FE20型實驗PH計測得0.1mol/L FeSO4溶液的pH為4.21,,激光筆照溶液有丁達(dá)爾現(xiàn)象,。【現(xiàn)象解釋】新配制FeSO4溶液水解顯酸性,,說明反應(yīng)I速率較快,、程度較大。
FeSO4溶液變質(zhì)探究
取兩支試管標(biāo)為①⑥,分別加人5mL0.1mol/LFeSO4溶液,,試管 ①密封,、試管⑥敞開,。放置一段時間,觀察溶液顏色,用激光筆照溶液;再分別取1mL試樣于試管中,加兩滴0.1mol/L KSCN溶液檢驗Fe3+,。注意,,F(xiàn)e2+水解程度可據(jù)溶液的渾濁度(丁達(dá)爾現(xiàn)象)判斷,Fe2+的氧化程度可據(jù)Fe3+遇KSCN的變色深淺判斷。實驗現(xiàn)象如表1所示,。

實驗結(jié)論
綜合上述現(xiàn)象,,我們可以得出鐵粉、酸對FeSO4,,保存溶液的影響:向密封FeSO4,,溶液加過量純鐵粉可有效防上Fe2+氧化生成Fe3+,但Fe2+水解程度大,,試管溶液中有較多黃色不溶物生成,。
向密封FeSO4,溶液中加少量稀硫酸可以有效防止Fe2+水解,,試管溶液一直澄清,,但Fe2+氧化生成的Fe3+多。
向密封FeSO4,,溶液中加少量稀硫酸,、過量鐵粉,短時間(24h內(nèi))可以防止Fe2+水解而加速Fe2+氧化,,長時間(24h后)可以防止Fe2+氧化而加速Fe2+水解,。
所以,保存FeSO4溶液加硫酸,、鐵粉各有利弊 ,。有的人提供保存FeSO4的方法與操作精確測定0.1mol/LFeSO4溶液pH為4.21<5),但Fe2+水解程度大,試管有較多黃色不溶物生成,,此方法不能有效保存Fe2+溶液,。
問題解決

我們認(rèn)為保存硫酸亞鐵溶液要重點(diǎn)防止Fe2+氧化,措施是除去氧,、加鐵粉,;其次,防止Fe2+水解,,措施是加稀硫酸,。結(jié)合實驗出現(xiàn)的反常現(xiàn)象,,在實驗中采取如下保存方法:向新配制0.1mol/LFeSO4溶液中加1mL2mol/L稀硫酸和過量純鐵粉,,開始不塞緊橡皮塞(排除氧氣),搖動試劑瓶待不再產(chǎn)生明顯氣體后塞緊配有“玻璃導(dǎo)管+氣球”的橡皮塞(平衡氣壓,,形成H2的還原氣氛,,減緩Fe2+氧化),,裝置如圖1所示。實驗證明,,按照此保存方法,,24h內(nèi)FeSO4溶液幾平不發(fā)生氧化和水解,,適合做相關(guān)演示實驗,;若FeSO4溶液保存較長圖1實驗裝時間(一周左右),待用時取出上清液于試管,,加幾滴稀硫酸防水解,,再做相關(guān)演示實驗,效果好,。
當(dāng)然,,亞鐵鹽在保存、使用中,,F(xiàn)e2+的氧化和水解等變質(zhì)現(xiàn)象不可避免,,我們通過實驗探究和理論分析,研究亞鐵鹽“相對合理”的保存方法,,以期逐漸接近科學(xué)事實的真相,,為化學(xué)實驗提供參考。
相關(guān)文章:------------固體硫酸亞鐵如何保存方法
相關(guān)文章:------------固體硫酸亞鐵如何保存方法





