硫酸亞鐵含量的測(cè)定
1,、原理
在酸性介質(zhì)中,,用高錳酸鉀標(biāo)準(zhǔn)滴定溶液滴定,使二價(jià)鐵離子氧化成三價(jià)鐵,,以滴定液自身指示終點(diǎn),。
2、試劑和儀器
2.1硫酸溶液:1+1
2.2磷酸溶液:1+1
2.3 高錳酸鉀標(biāo)準(zhǔn)滴定溶液:c(1/5KMnO4)約0.1mol/L
3,、測(cè)定步驟
稱量約1g試樣,,精確到0.0002g。置于250ml錐形瓶中,。用50ml水溶解,。加10mL硫酸溶液和4mL磷酸溶液。以高錳酸鉀標(biāo)準(zhǔn)滴定溶液滴定至溶液呈粉紅色(30s不褪)即為終點(diǎn),。同時(shí)作空白試驗(yàn),。
4、計(jì)算
硫酸亞鐵(FeSO4?7H2O)含量以質(zhì)量分?jǐn)?shù)W1計(jì),,數(shù)值以%表示,,按下式計(jì)算:
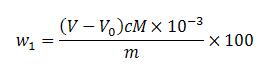
式中:
V——滴定時(shí)消耗高錳酸鉀標(biāo)準(zhǔn)滴定溶液的體積的數(shù)值,單位為毫升(mL),;
V_0——空白試驗(yàn)消耗高錳酸鉀標(biāo)準(zhǔn)滴定溶液的體積的數(shù)值,,單位為毫升(mL);
c——高錳酸鉀標(biāo)準(zhǔn)滴定溶液濃度的準(zhǔn)確數(shù)值,,單位為摩爾每升(mol/L),;
M——硫酸亞鐵(FeSO4?7H2O)的摩爾質(zhì)量的數(shù)值,單位為克每摩爾(g/mol),;【M(FeSO4?7H2O=277.9】,;
m——試料的質(zhì)量的數(shù)值,,單位為克(g)。
相關(guān)文章:-------------硫酸亞鐵檢測(cè)報(bào)告





